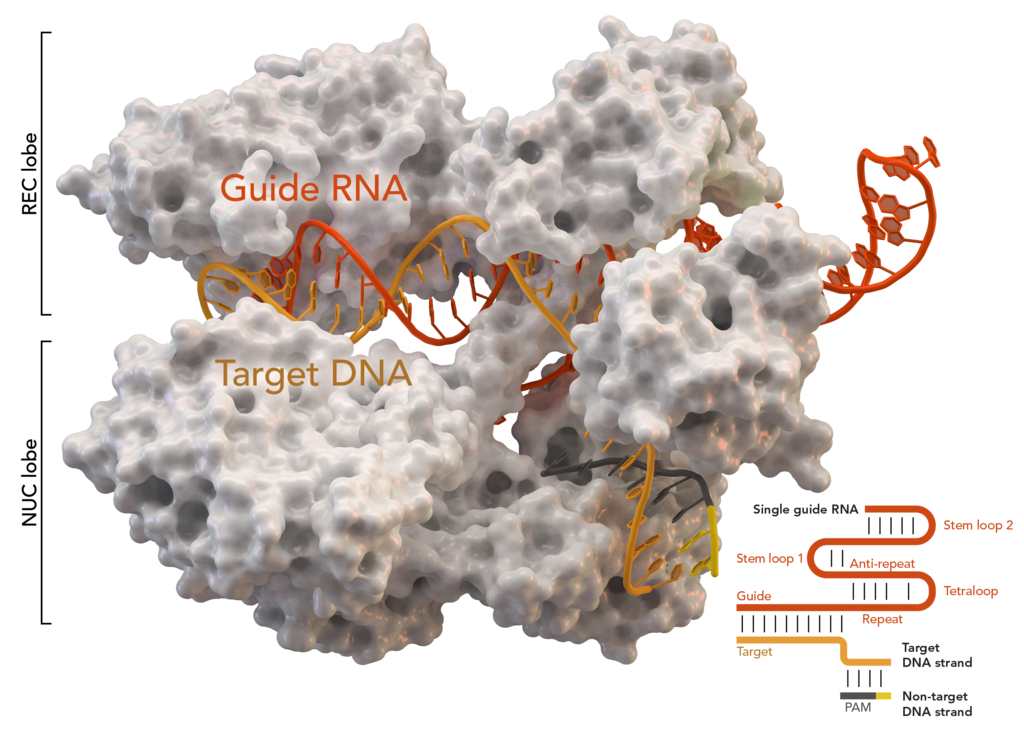
Кристаллическая структура S. aureus Cas9 в комплексе с crРНК и её целевой ДНК
В прошлых постах вы просили подробнее рассказать про CRISPR/Cas9 и подходы к редактированию генома. Я просто не стал включать столь объемный материал в прошлый пост. А в этот не включу, например метод TALEN, который потенциально может быть более точным и имеет свои плюсы. Но дорогой, да.
Попробуем пройтись по уже достаточно хорошо описанному методу генетической модификации с помощью CRISPR-Cas9 и посмотрим чуть шире на перспективы, которые он для нас открывает. Меня дико заинтересовало направление по ксеногенной трансплантации от свиней к человеку. Первые, «докоррекционные» методы показали, что такой свиной трансплантат убивается организмом в течение нескольких минут. Но метод не отбросили совсем. Все-таки это — перспективный способ не ждать пока погибнет очередной потенциальный донор органов, а вырастить их заранее. Потом выяснилось, что свиньи еще и поголовно носят в себе пачку специфичных ретровирусов, которые встроены в их геном и могут вызвать эпидемию нового ксенозооноза. И вирусы тоже как-то надо выковыривать перед трансплантацией. И вот где-то тут выходят на сцену люди в белых халатах, которые делают что-то непонятное в своих лабораториях…
Бактериальный антивирус, который все перевернул
В 1987 году CRISPR был обнаружен японскими учеными во главе с Ёсидзуми Исино. На тот момент они обратили внимание на необычные повторы в геноме кишечной палочки, но особо значения этому не придали. И только когда аналогичные повторы нашли у археев, которые генетически очень далеки от кишечной палочки, начали поиск аналогичных структур у других прокариот. Эти фрагменты назвали CRISPR — clustered regularly interspaced short palindromic repeats. Немного позднее обнаружили еще и специальные CRISPR-ассоциированные белки — Cas (CRISPR associated protein). Ну обнаружили и обнаружили, казалось бы. Но именно они стали началом новой биотехнологической революции.
Сейчас попробую рассказать как это работает и зачем оно бактериям. Бактерии очень хотели бы выжить. Но на них любят паразитировать вирусы. Когда тебя кто-то жрет — это неприятно и надо что-то делать. В итоге, ответом стал сложный, но крайне интересный механизм. Бактерия трепетно хранит в куске своего генома сигнатуры всех злодеев, которые пытаются ее заразить. Это и есть те самые повторяющиеся палиндромные участки — CRISPR. Работают они совместно c белками из группы Cas. Нас интересует ключевой Cas9. Как это вообще выглядит вживую, если немного упростить?
Если эта система не работает, то клетка бактерии оказывается не в состоянии отличить вирусный геном, заботливо введенный бактериофагом, от ее собственного. И не сильно умная система синтеза белка немедленно переориентируется на выпуск новых поколений фагов. Клетка гибнет.
Если CRISPR/Cas9 срабатывает, то процесс идет иначе. Бактерия использует данные, записанные в CRISPR для создания управляющей РНК. Комплекс белков начинает раскручивание ДНК с целью проверки перед «запуском». В случае, если последовательность совпадает с вирусными сигнатурами, записанными в CRISPR, Cas9 поднимает тревогу и немедленно отрезает распознанный вражеский фрагмент. То есть, даже если вирус встроился в геном бактерии на уровне «прошивки», то он будет оттуда вырезан сразу, как только его распознает встроенный антивирус.
Нобелевская премия
За создание новых технологий, позволяющих проводить с помощью CRISPR-Cas9 редактирование генома Эмманюэль Шарпантье и Дженнифер Даудна получили Нобелевскую премию по химии 2020 года. Эта технология позволила заменить более точные на тот момент, но более сложные и дорогие методы zinc fingers и нуклеазы TALEN. Прошлые методы требовали для каждого нового локуса-мишени разработку, экспрессию и проверку совершенно новой пары полипептидов. А CRISPR-Cas9 дал стандартный инструмент, при использовании в минимальном варианте достаточно получить нужную управляющую последовательность, по которой Cas9 найдет нужный для рассечения участок.
Ладно, мы разрезали ДНК человека, дрожжей или подопытной крысы. Это круто, но теперь у нас два разорванных куска и уничтоженная цепочка. Есть несколько вариантов сшивки обратно.

Можно попытаться сопоставить отрезанные фрагменты по методу негомологичного соединения концов. Он слева. Если упросить, то в этом варианте мы просто пытаемся состыковать двойной разрыв напрямую и сварить в единое целое. Этот механизм довольно неэффективен, в процессе «подгонки» могут выпадать отдельные концевые участки. В результате часто теряются небольшие фрагменты в зоне обрыва или наоборот возникают короткие вставки. Этот подход обычно необратимо выключает ген, делая его дефектным.
Второй вариант более интересен. Он на иллюстрации справа. Репарация путём гомологичной рекомбинации, подразумевает замену удалённой последовательности новой последовательностью, комплементарной матрице для репарации, которую создаёт сам исследователь. В итоге есть возможность не просто выключить как-то ген, а заменить мутантную последовательность нормальной.
Основная проблема метода в том, что он вероятностный. Да, в большом проценте случаев он отработает именно так, как надо. Но во многих клетках он либо не даст нужный эффект, либо что-то к чертям сломает. И хорошо, если просто единичные клетки от этого погибнут, а не станут, например, опухолевыми. Поэтому все подобные изменения надо тщательно тестировать. К счастью, относительно свежие подходы по улучшению специфичности путем создания кастомной Cas9 позволяют уменьшить число ошибочных разрезов почти до нуля.
Ксенотранспланты
Как я уже говорил, массовое применение подобных техник останавливает специфичность. Если наша чудная молекула просто пропустит 20% клеток — это не страшно. Это будет значить, что 80% клеток человека с врожденной мутацией исправлены и уже начнут производить корректный фермент, адекватно делиться или делать что-то другое правильно. Как правило этого более чем достаточно, чтобы человек стал клинически здоровым.
В этом разделе я бы хотел немного рассказать о том, как редактирование генома может потенциально решить проблему донорских органов. Надо сказать, что нехватка органов для трансплантации выглядит очень печально. Огромные сроки ожидания и куча этических проблем.
Количество производимых в России трансплантаций органов в сотни раз ниже потребности. Если ту же почку можно пересадить от подходящего родственника, то трансплантация сердца уже гарантировано означает смерть донора. Одно из ключевых направлений в поиске неограниченного источника органов — ксенотрансплантация. Это вариант пересадки тканей и органов между разными видами. Один из наиболее подходящих по строению и размерам для человека доноров — это свинья, как ни странно. Приматы хоть и ближе генетически, но в основном сильно меньше в размерах и очень дороги в разведении. К сожалению, первые эксперименты по пересадке свиных органов показали, что они начинают отторгаться со сверхострой реакцией в течение нескольких минут после подключения к кровотоку.
Как доработать свинью

Для того, чтобы трансплант не отторгался необходимо как минимум нокаутировать целевые гены отвечающие за синтез наиболее чужеродных нам белков. Первый такой белок — это фермент альфа-1,3-галактоза, который у всех приматов необратимо сломан в процессе эволюции. Именно он вызывает начало отторжения в течение нескольких минут. Генная коррекция позволила создать породу свиней с выключенным геном, отвечающим за синтез фермента — GTKO свиньи. Хотя это значительно замедлило процесс отторжения, но полностью его не остановило. Выяснилось, что проблемными являются еще N-гликолилнейраминовая кислота и β1,4 N-ацетил галактозаминилтрансфераза, которые у приматов отсутствуют. Эти гены тоже нокаутировали и получили свиней GGTA1/CMAH/β4GALNT2 KO с выключением сразу всех трех генов. Предположительно, это сможет практически нивелировать реакцию отторжения. В теории, если получится еще и заставить клетки свиней синтезировать поверхностный гликопротеин CD47 человека, то совместимость будет прям совсем отличной.
В 2018 году была очень многообещающая публикация по трансплантации сердца от ГМО-свиньи бабуинам. Из 5 бабуинов только у одного были проблемы, начался отек легких по хирургическим причинам и его пришлось вывести из эксперимента раньше времени. Остальные дожили до окончания своего срока эксперимента с хорошим самочувствием. Двое до трех месяцев и двое до полугода. Были некоторые проблемы из-за роста органа, так как свиное сердце крупнее бабуиньего, но для человека это не будет проблемой.
Не ждет ли нас новый ВИЧ

Филогенетическое дерево ВИЧ и родственных ему вирусов у шимпанзе
Казалось бы нас ждет светлое будущее, где для производства донорских органов будет пастись отдельное стадо специальных лабораторных хрюшек. Но и тут всплывает куча этических проблем. Я подозреваю, что такой метод будет неприемлем для представителей ряда религий, что автоматически делает его недоступным для большой доли населения планеты.
А еще у свиней есть ретровирусы. К ним, например, относится такой чудесный лентивирус, как вирус иммунодефицита человека и родственные ему вирусы приматов. Считается, что именно вирус примата дал начало массовой эпидемии ВИЧ в 70-х годах прошлого века. И сейчас человек не знает, что с ним делать. Свиньи же являются носителями PERVs — porcine endogenous retroviruses. И от этих вирусов нельзя избавиться аккуратным разведением и противоэпидемическими мерами, так как вирусы уже прочно встроены в геном их клеток. Было проведено исследование, которое должно дать возможное решение. Для начала они взяли клетки свиньи и вырастили их на одной культуре с эмбриональными клетками из человеческой почки. Самое неприятное, что они смогли выявить человеческие клетки, инфицированные свиными ретровирусами, что потенциально говорит о такой возможности при трансплантации. В качестве решения они предложили предварительную обработку клеток с помощью CRISPR-Cas9 и полного вырезания всех вирусных фрагментов из культуры клеток почечного эпителия свиньи.
Биотех и риски
К чему все это приведет, предсказать сложно. К сожалению, риски получить экзотического вирусного мутанта от подобной трансплантации вовсе не нулевой. И есть шанс, что подобная инфекция также может распространяться тихо и незаметно, прежде чем не станет очевидной, как это произошло в свое время с ВИЧ. И все же я скорее полон оптимизма. Мы неизбежно наступим на много грабель в процессе исследований, но уже сейчас у нас появились инструменты для лечения смертельных ранее заболеваний и продления жизни людей.

