Вопрос устройства зрения заметная часть нейробиологии. Данному вопросу посвящены огромные объемы литературы и четыре нобелевские премии, но в сложившейся ситуации нельзя не заметить то, что изложенное в учебниках устройство зрения млекопитающих не справляется с поставленной задачей. Цель данного эссе показать свод причин, почему не стоит закрывать на это глаза. По сути, будет предъявлен портрет тайны зрения, начиная от разнообразия мелких деталей в самом начале потока зрительной информации у млекопитающих, угрозы от их игнорирования, и заканчивая ворохом проблем в понимании обработки мозгом в конце пути.
На взгляд любого учебника о зрении мы видим в три этапа. Первый этап: свет попадает на сетчатку и преобразуется в нервное возбуждение фоторецепторов – сенсорных нейронов сетчатки. Кроме того глаз нормализует контрастность и яркость, фокусирует изображение. Второй этап: процесс в сетчатке, когда карта нервных возбуждений фоторецепторов трансформируется в параллельный информационный поток, каждый элемент которого кодирует свой аспект зрительной информации. Ганглиозных клеток, чьи аксоны образуют зрительный нерв, в сетчатке гораздо меньше чем фоторецепторов, происходит первое сжатие информации. Одна ганглиозная клетка может отвечать за кодирование сигнала от нескольких в центре до сотен и тысяч фоторецепторов на периферии сетчатки. (рисунок 1) Ганглиозные клетки разделают на два основных типа в зависимости от того каким маршрутом от зрительного нерва сигнал попадает в кору больших полушарий головного мозга. Один тип преобладающий количественно (80% у людей) дает высокую остроту зрения и цветовосприятие, для них важен стабильный контраст изображения. По историческим причинам они носят название ПЦ клеток или карликовые, так как сигнал от них проходит через парвоцеллюлярные (мелкоклеточные) слои латеральных коленчатых тел. Второй тип МЦ клетки, их сигнал идет через магноцеллюлярные (крупноклеточные) слои латеральных коленчатых тел. Отвечают за восприятие движения, так как имеют повышенную чувствительность к изображениям, которые вспыхивают или перемещаются.



Рисунок 1. Измерение свойств рецептивных полей. (A) Реакция нейрона (последовательность потенциалов действия или «спайки») контролируется внеклеточной регистрацией электродом в промежуточном коленчатом теле (LGN) анестезированного животного. Стимулы подаются в соответствующий нейрону участок поля зрения. (B) Таблица условных ответов разных типов нейронов. Каждый столбец показывает ответ одного типа нейронов. Каждый ряд показывает ответы на один тип стимула. Например, нейрон, избирательный по направлению движения (второй столбец), реагирует только тогда, когда стимул движется через рецептивное поле снизу слева вверх направо. Нейроны, которые имеют стандартные «центр/окружение» рецептивные поля, толерантны к размеру и к подвижности стимула. Нестандартные типы нейронов демонстрируют гораздо более бескомпромиссные требования к стимулу.
Оба типа этих клеток обладают организацией по типу «центр/окружение»: предположительно универсальной стратегией кодирования зрительной информации. (рисунок 2) Лучшим стимулом, позволяющим добиться самого энергичного ответа от ганглиозных клеток, является более-менее округлое и маленькое пятнышко на сетчатке, и чем интенсивней оно контрастно выделяется на окружающем фоне (яркое или темное пятно), тем энергичным является ответ клеток.
Третий этап: сигнал обрабатывается в мозге. С общепринятой точки зрения основные процессы обработки мозгом начинаются в первичной зрительной коре. Происходит очередное значительное перекодирование, нейроны не просто реагируют на темные и светлые пятна на поверхности сетчатки, но и становятся избирательно чувствительными к ориентированным контрастным границам, ориентированным участкам линий и их концам. Существуют и более сложные конфигурации стимулов, когда нейроны реагируют именно на границу контраста независимо от положения, лишь бы она находилась в зоне ответственности клетки. Эта «сложная» обработка в зрительной коре используется как второй уровень абстрагирования при восприятии статической картинки, где распознавание выходило на новый более общий уровень восприятия границ независимо от их положения. В итоге: сперва сетчатка передает простые сигналы в кору головного мозга; во-вторых, нейроны первичной зрительной коры используют эти простые сигналы для обнаружения контрастных границ и линий; и в-третьих, эти фундаментальные строительные блоки используются для определения границ целых объектов и создания визуального восприятия.
Вероятно, никто не предполагал, что данная точка зрения превратится в гранит фундаментальной догмы. Обнаружение краев стало рассматриваться как если бы оно было единственным способом видеть у млекопитающих, как найденное эволюцией идеальное решение проблемы эффективного восприятия изображений. В данном эссе будет поставлена под сомнение эта точка зрения и будут заданы неудобные вопросы о природе зрения. Они уже не раз были подняты за историю изучения зрения и не предполагают простых ответов. Так что сейчас основная задача состоит в том, чтобы сконцентрироваться на этих вопросах, собрав вместе причины для сомнений в современном понимании устройства зрения.
Тщательное исследование маршрута зрительного потока от глаз к коре больших полушарий у приматов безапелляционно подтверждает, что, как и у других видов млекопитающих, функциональный вклад в зрительный поток приматов вносят множество параллельных каналов [1–4]. (Рисунок 2) Некоторые из этих каналов даже игнорируют первичную зрительную кору и сразу направляются в более высокие по иерархии отделы [5]. Многое из этого упоминалось в классических исследованиях анатомии кошек и обезьян [6–10], но игнорировалось пионерами нейробиологии при исследовании зрительной коры. Агрессивное использование принципа бритвы Оккама позволило придать смысл свойствам корковых нейронов, как они строят свою функцию распознавания линий или границ исключительно на основе входов от ганглиозных клеток с организацией «центр/окружение» [11]. Были отброшены имеющие сравнительно низкое количество в сетчатке приматов ганглиозные клетки с нестандартной организацией. Какова их роль в зрительном восприятии, будет описано далее, а с точки зрения практиков нейробиологии стоит заметить, что при произвольном внедрении электрода в зрительный нерв, вероятность натолкнутся на аксон нестандартной ганглиозной клетки достаточно мала. Поскольку нестандартные клетки встречаются редко, большинство экспериментаторов предпочли пойти по пути наименьшего сопротивления, создавая методики проецирования зрительных стимулов на сетчатку, наилучшим образом подходящих для изучения клеток «центр/окружение», что превратило нестандартные клетки в статистический «выброс» в экспериментальных данных.
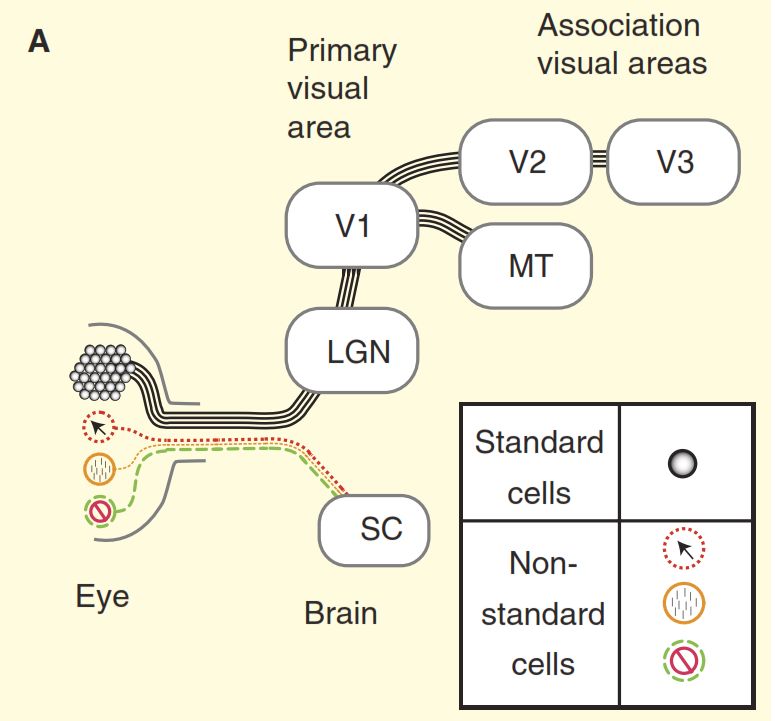
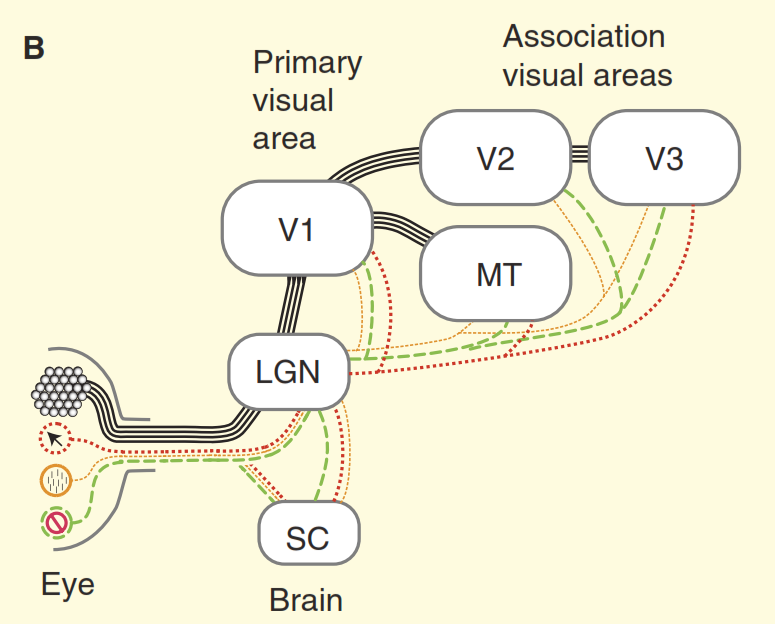
Рисунок 2. Представления о зрительной системе.
(A) Точка зрения из учебников на устройство зрительной системы приматов на примере макаки. Сетчатка заполнена большим количеством стандартных ганглиозных клеток, аксоны которых образуют зрительный нерв. Сетчатка также содержит небольшое количество нестандартных ганглиозных клеток, которые реагируют на свет другими способами, но традиционно предполагается, что они проецируются только в вегетативные центры среднего мозга, а именно в верхнее двухолмие (SC). Концентрические клетки выступают в релейное ядро в таламусе, промежуточной коленчатом теле (LGN), которое, в свою очередь, передает сигналы в первичную зрительную кору (V1). А стандартные клетки через промежуточное коленчатое тело (LGN) передают сигнал в первичную зрительную кору (V1) и далее в высшие отделы зрительной коры (V2, V3, MT).
(В) Более реалистичный взгляд на зрительную систему приматов. Часть из нестандартных ганглиозных клеток отравляют сигнал непосредственно в промежуточное коленчатое тело (LGN), а затем в первичную зрительную кору. Кроме того верхнее двухолмие не является тупиковым направлением, оттуда сигнал идет в промежуточное коленчатое тело (LGN) и далее. Но и это еще не всё, начиная с в промежуточного коленчатого тела (LGN) зрительный поток перестает быть однонаправленным, а его обратная составляющая мощнее прямой.
Вторая проблема проиллюстрирована на рисунке 3. На верхнем графике рисунка показан ответ клетки «центр/окружение». Базовая схема реакции очень хорошо знакома нейробиологам, занимающимся зрением: стандартные ганглиозные клетки «центр/окружение» показывают кривую линии-отклика на пространственную частоту — максимальный отклик возникает, когда полоса решетки точно совпадает по ширине с участком «центр» рецептивного поля клетки «центр/окружение». Но теперь рассмотрим ответ одной из нестандартных клеток в зрительном нерве, полученном в том же эксперименте (рисунок 3 б). В этот раз клетка принадлежит к так называемому кониоцеллюлярному типу ганглиозных клеток, сводному набору нестандартных типов клеток, который обычно обобщается, если он вообще упоминается, как «путь синего цвета». Эта клетка обладает организацией по типу «подавление контрастом» [6,7,12,13], в данном эксперименте её ответ почти полностью противоположный ответу стандартной клетки «центр/окружение». При учете поправки на разницу в остроте зрения обезьян и кошек, ганглиозные клетки «подавления контрастом» ведут себя одинаково [12,13].
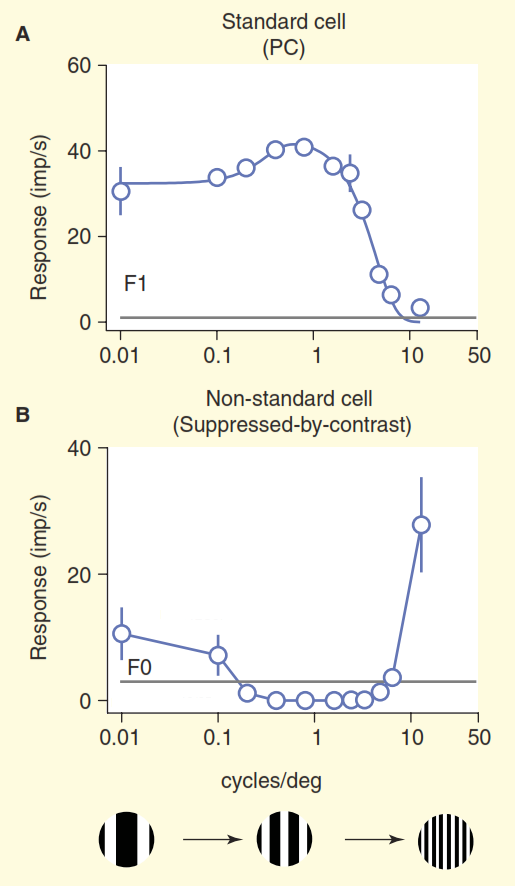
Рисунок 3. Сравнение стандартного и нестандартного рецептивного поля. Клетки стимулировались дрейфующей решеткой с изменяемой пространственной частотой (частота здесь выражается в виде общей ширины двух полос черной и белой в решетке на градус угла обзора). Стандартная «центр/окружение» ганглиозная клетка (A) ведет себя так, как и ожидалось: когда ширина полосы решетки близка к ширине центра рецептивного поля, клетка дает сильный ответ. Нестандартная клетка с «подавлением контрастом» (B) вместо возбуждения молчит, до тех пор пока способна различать черные и белые полосы.
Нам остается только предполагать, что эти клетки распознают монотонную заливку в зоне своей ответственности, например, чистое голубое небо, так как при уменьшении ширины белых и черных полос решетки ниже разрешающей способности человеческого глаза они сливаются в сплошной серый. Верного понимания о кодировании зрительной информации для этих клеток не представлено в стандартной модели зрения.
Защитники принятой модели зрения при рассмотрении приматов могут ссылаться на относительно крайне малое количество нестандартных клеток, но это не относится к сетчаткам кроликов, кошек, крыс и мышей [7,8,14– 16]. Кроме того, в абсолютных числах (около 100 000) число нестандартных клеток в сетчатке приматов близко к общему количеству клеток в сетчатке крысы или кошки [17]. Острота зрения у кошек, кроликов, крыс и мышей ниже, чем у приматов, но острота это еще не все. Зрение всех этих существ позволяет успешно справляться с выживанием в дикой природе. Любому, кто сомневается в этом, предлагается попытаться подкрасться к кролику в поле или поймать мышь, не пользуясь мышеловкой (простая задача для обычной кошки).

Рисунок 4. Зрительное восприятие при низкой детализации.
Наблюдатели, знакомые с представленными на изображении персонами, распознают их несмотря на низкую детализацию. При размытии изображения для человека остается достаточно полезной зрительной информации. Слева направо: принц Чарльз, Вуди Аллен, Билл Клинтон, Саддам Хуссейн, Ричард Никсон, принцесса Диана.
Понятно, хотя бы по медицинским мотивам, почему нейробиологи сконцентрировались на сетчатке приматов. Но такая избирательная концентрация при попытке понимания зрения приводит к тому, что экспериментаторы привносят и переносят результаты самовосприятия на трактовку результатов проводимых исследований. Плотная упаковка ганглиозных клеток приматов хорошо подходит для обнаружения съедобных фруктов на дереве, или же для чтения свежего номера «Нью Йорк Таймс», но нет особых причин рассматривать такие задачи как summum bonum (лат.: высшее благо) зрения. В общей эволюционной картине эту крайне высокую остроту зрения можно рассматривать как специфическую нишевую адаптацию для обнаружения на большом расстоянии высококонтрастных объектов. У большинства млекопитающих в сетчатке нет фовеа (центральной ямки в сетчатке) — специализированной области с высокой остротой зрения, обнаруженной у приматов, — но зрение без миллиона плотно упакованных ганглиозных клеток остается вполне работоспособным. Доказательство проиллюстрировано на рисунке 4, люди легко способны к узнаванию без привычной остроты зрения [18]. У млекопитающих, не являющихся приматами, кодирование зрительных стимулов особенно хорошо изучено у кроликов [19–23]. У кроликов большие глаза, а оптическая система лучше, чем у многих видов приматов, так же в их сетчатке есть стандартные ганглиозные клетки «центр/окружение». Однако эти стандартные клетки составляют лишь четверть от всей популяции ганглиозных клеток сетчатки, представленной около двенадцатью функциональными и анатомическими типами [14,21]. Понятно, что каждый из этих двенадцати типов клеток заточен эволюцией под свои зрительные стимулы. Но важность данного факта заключается в том, что в зрительном потоке текущем в мозг кролика преобладают каналы именно от нестандартных ганглиозных клеток. Эта информация не нова: новшеством же является доказательство того, что сетчатка всех млекопитающих передает многообразие кодирующих зрительных каналов в мозг [4, 13, 24, 25] и что такое разнообразие должно быть включено в любой реалистичный взгляд на устройство зрения.
Известным примером являются клетки избирательно реагирующие на направление движения стимула. Один тип из них напрямую отправляет сигнал в ядра ствола мозга, связанные с движением глаз [26]. Но не столь общеизвестен другой тип этих клеток, сигнал от которых идет не только в средний мозг, но и через латеральные коленчатые тела в первичную зрительную кору [19]. Такие клетки не так уж и редки, однако упоминания о них в учебниках при описании устройства зрения не встречается. Сигнал от нестандартных ганглиозных клеток однозначно доходит до зрительной коры, но как он использует?
Второй нестандартный тип клеток (идентифицированный у кроликов, кошек и мышей) — это так называемый локальный детектор края. Подобно клеткам избирательно реагирующим на направление движения, они также когда-то считались редкими ганглиозными клетками, но теперь мы знаем, что это произошло из-за ошибки при использовании электродов: они, вероятно, составляют около 15% всех ганглиозных клеток [23]. Сигналы от этих клеток также достигают первичной зрительной коры, но их ответы лежат далеко за пределами стандартных зрительных реакций [8,22,23]. Эти клетки лучше всего реагируют на небольшие, медленно движущиеся цели, такие как хищник или хищное животное, двигающееся на удаленном расстоянии. Однако, если есть много мелких объектов, как на текстурированном поле, клетки перестают реагировать. Другими словами, клетки реагируют на небольшой движущийся объект, но только тогда, когда он в одиночестве.
Локальный детектор края, по-видимому, является наиболее многочисленным типом ганглиозных клеток сетчатки у кролика, но он не был включен в стандартную модель зрения. Могут ли эти клетки сформировать систему анализа движения на удаленных расстояниях? Как зрительная кора обрабатывает сигналы от этих клеток? Как другие виды млекопитающих воспринимают мир стандартными ганглиозными клетками и локальными детекторами краев — или даже клетками с другим сжатием зрительной информации, который еще предстоит обнаружить?
Даже если сделать допущение, что весь зрительный поток кодируется только стандартными клетками сетчатки, на данный момент времени известно, что обработка в первичной зрительной коре не происходит исключительно по первоначально предложенному способу с помощью «простых», «сложных», «гиперсложных» нейронов, а также нейронов «с концевым торможением». Обсуждению данного факта уделено много места в специализированной литературе [27–30].
Проблемы начинаются с другого очевидного факта, что почти все нейроны в коре мозга нелинейны, что ставит под сомнение полезность иерархических схем с линейными допущениями в трактовке их функции [31,32].
Во-вторых, идея трех основных типов клеток – «простых», «сложных» и «гиперсложных» — является грубой абстракцией богатого разнообразия типов клеток первичной зрительной коры, выявленных анатомическими методами [33,34]. В-третьих, нейроны зрительной коры зависят не только от входящего зрительного потока, но и от различных контекстных сигналов своих соседей, так что реакция на те же стимулы являющиеся частью картины повседневности и искусственно созданными экспериментаторами может разниться [27,35]. Ответы нейронов зрительной коры даже не фиксированы во времени: удаление небольшого участка сетчатки, которое приводит к появлению слепого пятна, позволяет нейронам оставшимся без работы со временем сменить свою зону ответственности и обрабатывать зрительную информацию из ближайших к слепому пятну рабочих участков сетчатки [36].
С точки зрения анатомии ничего из перечисленного не является удивительным. Только до 10% от входа отдельного нейрона поступает из каналов зрительного потока [37], остальное приходит от соседних нейронов или от нейронов, расположенных в отдаленных вышестоящих частях коры головного мозга, где зрительные нейроны еще малоизучены и трактовка их функций составляет собой трудную задачу.
Таким образом, становится очевидным, что стандартное представление об устройстве зрения застряло в болоте догм. Какие шаги стоит предпринять, чтобы выбраться из него?
Последние хорошие новости заключаются в том, что методы визуализации клеток сетчатки за последние 5 лет претерпели незаметную революцию, так что теперь легко визуализировать их в больших количествах и с беспрецедентным качеством разрешения в виде трехмерного изображения. Проблема нахождения синапсов и взаимного расположения клеток легко разрешается, теперь и их можно классифицировать не только «на глаз», но и с помощью объективных методов классификации [15,16]. Степень соответствия морфологической типизации к физиологической типизации клеток сетчатки показывает прямую связь (рассмотрено в [24]). Таким образом структурные типы ганглиозных клеток сетчатки точно определяют количество функциональных каналов в зрительном потоке.
Во всех зрительных системах млекопитающих, изученных к настоящему времени, анатомические данные указывают на то, что число функциональных каналов составляет приблизительно двенадцать. В сетчатке обезьяны и кошки хорошо изучены функции примерно половины этих каналов. У кролика эта доля составляет около трети, сетчатки мыши и крысы, несмотря на их явное преимущество для генетических исследований, остаются в основном неизученными.
Таким образом, может оказаться полезным вернуться, вооружившись современными методами, к незавершенному делу 1970-х годов [38]. Задача состоит в том, чтобы завершить определение функций ганглиозных клеток, первого этапа сжатия зрительной информации, — избавится от слепых пятен в самом начале — и обновить свои цели в остальной части зрительной системы.
Почему после более чем полувека исследований, знания о физиологии зрения так сильно отстают от знаний анатомии, и что можно сделать для улучшения ситуации? Отодвигая в сторону проблему избирательности исследований с помощью электрода, основной проблемой остается выбор методики для поиска верного стимула.
Понять, для чего именно используются в системе зрения ганглиозные клетки сетчатки и нейроны в первичной зрительной коре – какова их настройка на характеристики видимого окружения – оказывается гораздо сложнее, чем предполагали пионеры нейробиологии. Классическая техника исследования заключалась в том, что экспериментаторы слушали усиленный сигнал с электрода случайным образом погруженный в зрительный нерв или в кору мозга в то время как вручную передвигали проецируемый на сетчатку стимул в поисках зоны ответственности клетки к которой и прикоснулся электрод. Быстрый и эффективный метод, но страдающий субъективностью и недостаточной воспроизводимостью. Простые решетчатые стимулы и линейный системный анализ чрезвычайно эффективны для стандартных клеток [38,39], но, как говорилось ранее, этот метод плохо подходит к исследованию нестандартных клеток и нелинейных нейронов первичной зрительной коры. Интересны новые попытки определить наборы верных стимулов [40], но консенсуса пока нет.
Альтернатива основана на стратегии обратной корреляции [41–43], где случайно выбранный экспериментатором стимул предъявляется множество раз, а ответная реакция клетки используется для расчета обратного усреднения. Таким образом, экспериментатор может построить представление усредненного стимула, приводящего к самой активной реакции клетки. Большое преимущество этого метода заключается в том, что он не предполагает какой-либо конкретной настройки клетки на тестовый стимул. Как по теоретическим, так и по аналитическим причинам, тестовый стимул обычно выбирается как «случайный»: мерцающая шахматная доска или какая-либо другая форма визуального шума. Эта стратегия элегантна с точки зрения концепции, но в значительной степени ограничена анализом клеток со стандартной организацией «центр/окружение», поскольку нестандартные клетки (по определению) настроены на весьма неслучайные особенности зрительной информации.
Другая альтернатива использует более радикальный подход. Стратегия заключается в поиске обратной корреляции отклика клетки на изображение, снятом на видео в повседневной обстановке и предъявленном на экране монитора[27,44]. Идея заключается в том, что исследователь ждет от клетки сигнал, когда появится важный для неё стимул. Работоспособность такого метода была доказана экспериментально, но остается открытым вопрос насколько естественным следует считать двухмерное изображение, как этот метод будет учитывать эффекты нелинейности и контекста, и тем более как трактовать результаты.
Обратное сопоставление окружающего мира сигналам в мозге можно рассматривать как эмпиризм, доведенный до крайности. Но что могут предложить теоретики от нейробиологии в противовес своим коллегам экспериментаторам? У них есть возможность успешно выйти за рамки популярного в настоящее время стиля, с формальной точки зрение являющимся лишь переформулированием экспериментальных результатов. Не смотря на четверть века усилий, большая часть проведенной работы не смогла пройти проверку временем и не нашла подтверждения в новых экспериментальных фактах. Хотя точные и компактные формулировки экспериментальных результатов имеют важное значение, они редко приводят к синтезу новых знаний, а стремление к удобству математической оценки данных может накладывать невидимые ограничения на проводимые эксперименты. Конкретный пример был приведен ранее: если экспериментальный метод ограничен предъявлением в виде стимула решеток переменной ширины, ганглиозная клетка с организацией по типу «подавление контрастом» появляется только как «выброс» в экспериментальных данных, о котором исследователь не может сказать ничего другого.
Чем же тогда могут помочь теоретики? Им стоит разобраться с неудобными с вычислительной точки зрения аспектами реальной нервной системы. Например, экспериментальные физиологи слишком хорошо знают, что сенсорные системы являются линейными, только когда экспериментатор заставляет их быть такими [27,38,45]. Широкий охват теории зрения необходим, чтобы справляться с такими задачами как понимание достоинств избыточного и разреженного кодирования в зрительных системах, необходимость протянуть мосты между исследованиями зрения у беспозвоночных и позвоночных [46,47]. Вопрос состоит в том, даст ли результат переосмысление первого этапа в сжатии зрительной информации в сетчатке [46,48–50]. Ранее подчеркивалось разнообразие функциональных каналов зрительного потока, который при всем своем разнообразии служит нам в виде столь привычного чувства – зрения. В итоге главной задачей так и останется узнать каким образом мы просто «видим» и как вообще мы сможем это понять?
Устройство системы зрения
На взгляд любого учебника о зрении мы видим в три этапа. Первый этап: свет попадает на сетчатку и преобразуется в нервное возбуждение фоторецепторов – сенсорных нейронов сетчатки. Кроме того глаз нормализует контрастность и яркость, фокусирует изображение. Второй этап: процесс в сетчатке, когда карта нервных возбуждений фоторецепторов трансформируется в параллельный информационный поток, каждый элемент которого кодирует свой аспект зрительной информации. Ганглиозных клеток, чьи аксоны образуют зрительный нерв, в сетчатке гораздо меньше чем фоторецепторов, происходит первое сжатие информации. Одна ганглиозная клетка может отвечать за кодирование сигнала от нескольких в центре до сотен и тысяч фоторецепторов на периферии сетчатки. (рисунок 1) Ганглиозные клетки разделают на два основных типа в зависимости от того каким маршрутом от зрительного нерва сигнал попадает в кору больших полушарий головного мозга. Один тип преобладающий количественно (80% у людей) дает высокую остроту зрения и цветовосприятие, для них важен стабильный контраст изображения. По историческим причинам они носят название ПЦ клеток или карликовые, так как сигнал от них проходит через парвоцеллюлярные (мелкоклеточные) слои латеральных коленчатых тел. Второй тип МЦ клетки, их сигнал идет через магноцеллюлярные (крупноклеточные) слои латеральных коленчатых тел. Отвечают за восприятие движения, так как имеют повышенную чувствительность к изображениям, которые вспыхивают или перемещаются.



Рисунок 1. Измерение свойств рецептивных полей. (A) Реакция нейрона (последовательность потенциалов действия или «спайки») контролируется внеклеточной регистрацией электродом в промежуточном коленчатом теле (LGN) анестезированного животного. Стимулы подаются в соответствующий нейрону участок поля зрения. (B) Таблица условных ответов разных типов нейронов. Каждый столбец показывает ответ одного типа нейронов. Каждый ряд показывает ответы на один тип стимула. Например, нейрон, избирательный по направлению движения (второй столбец), реагирует только тогда, когда стимул движется через рецептивное поле снизу слева вверх направо. Нейроны, которые имеют стандартные «центр/окружение» рецептивные поля, толерантны к размеру и к подвижности стимула. Нестандартные типы нейронов демонстрируют гораздо более бескомпромиссные требования к стимулу.
Оба типа этих клеток обладают организацией по типу «центр/окружение»: предположительно универсальной стратегией кодирования зрительной информации. (рисунок 2) Лучшим стимулом, позволяющим добиться самого энергичного ответа от ганглиозных клеток, является более-менее округлое и маленькое пятнышко на сетчатке, и чем интенсивней оно контрастно выделяется на окружающем фоне (яркое или темное пятно), тем энергичным является ответ клеток.
Третий этап: сигнал обрабатывается в мозге. С общепринятой точки зрения основные процессы обработки мозгом начинаются в первичной зрительной коре. Происходит очередное значительное перекодирование, нейроны не просто реагируют на темные и светлые пятна на поверхности сетчатки, но и становятся избирательно чувствительными к ориентированным контрастным границам, ориентированным участкам линий и их концам. Существуют и более сложные конфигурации стимулов, когда нейроны реагируют именно на границу контраста независимо от положения, лишь бы она находилась в зоне ответственности клетки. Эта «сложная» обработка в зрительной коре используется как второй уровень абстрагирования при восприятии статической картинки, где распознавание выходило на новый более общий уровень восприятия границ независимо от их положения. В итоге: сперва сетчатка передает простые сигналы в кору головного мозга; во-вторых, нейроны первичной зрительной коры используют эти простые сигналы для обнаружения контрастных границ и линий; и в-третьих, эти фундаментальные строительные блоки используются для определения границ целых объектов и создания визуального восприятия.
Вероятно, никто не предполагал, что данная точка зрения превратится в гранит фундаментальной догмы. Обнаружение краев стало рассматриваться как если бы оно было единственным способом видеть у млекопитающих, как найденное эволюцией идеальное решение проблемы эффективного восприятия изображений. В данном эссе будет поставлена под сомнение эта точка зрения и будут заданы неудобные вопросы о природе зрения. Они уже не раз были подняты за историю изучения зрения и не предполагают простых ответов. Так что сейчас основная задача состоит в том, чтобы сконцентрироваться на этих вопросах, собрав вместе причины для сомнений в современном понимании устройства зрения.
Сетчатка всех млекопитающих посылает нестандартные сигналы в мозг
Тщательное исследование маршрута зрительного потока от глаз к коре больших полушарий у приматов безапелляционно подтверждает, что, как и у других видов млекопитающих, функциональный вклад в зрительный поток приматов вносят множество параллельных каналов [1–4]. (Рисунок 2) Некоторые из этих каналов даже игнорируют первичную зрительную кору и сразу направляются в более высокие по иерархии отделы [5]. Многое из этого упоминалось в классических исследованиях анатомии кошек и обезьян [6–10], но игнорировалось пионерами нейробиологии при исследовании зрительной коры. Агрессивное использование принципа бритвы Оккама позволило придать смысл свойствам корковых нейронов, как они строят свою функцию распознавания линий или границ исключительно на основе входов от ганглиозных клеток с организацией «центр/окружение» [11]. Были отброшены имеющие сравнительно низкое количество в сетчатке приматов ганглиозные клетки с нестандартной организацией. Какова их роль в зрительном восприятии, будет описано далее, а с точки зрения практиков нейробиологии стоит заметить, что при произвольном внедрении электрода в зрительный нерв, вероятность натолкнутся на аксон нестандартной ганглиозной клетки достаточно мала. Поскольку нестандартные клетки встречаются редко, большинство экспериментаторов предпочли пойти по пути наименьшего сопротивления, создавая методики проецирования зрительных стимулов на сетчатку, наилучшим образом подходящих для изучения клеток «центр/окружение», что превратило нестандартные клетки в статистический «выброс» в экспериментальных данных.
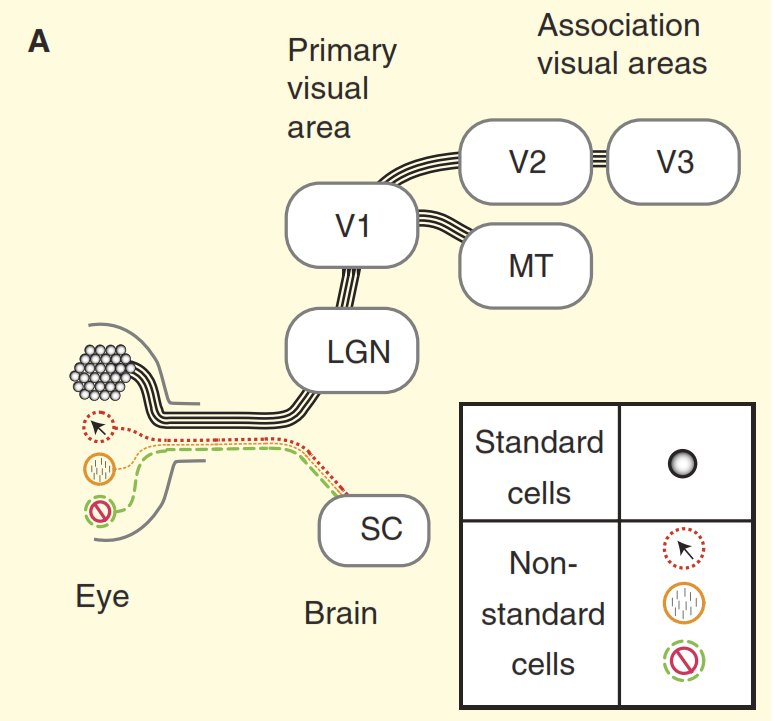

Рисунок 2. Представления о зрительной системе.
(A) Точка зрения из учебников на устройство зрительной системы приматов на примере макаки. Сетчатка заполнена большим количеством стандартных ганглиозных клеток, аксоны которых образуют зрительный нерв. Сетчатка также содержит небольшое количество нестандартных ганглиозных клеток, которые реагируют на свет другими способами, но традиционно предполагается, что они проецируются только в вегетативные центры среднего мозга, а именно в верхнее двухолмие (SC). Концентрические клетки выступают в релейное ядро в таламусе, промежуточной коленчатом теле (LGN), которое, в свою очередь, передает сигналы в первичную зрительную кору (V1). А стандартные клетки через промежуточное коленчатое тело (LGN) передают сигнал в первичную зрительную кору (V1) и далее в высшие отделы зрительной коры (V2, V3, MT).
(В) Более реалистичный взгляд на зрительную систему приматов. Часть из нестандартных ганглиозных клеток отравляют сигнал непосредственно в промежуточное коленчатое тело (LGN), а затем в первичную зрительную кору. Кроме того верхнее двухолмие не является тупиковым направлением, оттуда сигнал идет в промежуточное коленчатое тело (LGN) и далее. Но и это еще не всё, начиная с в промежуточного коленчатого тела (LGN) зрительный поток перестает быть однонаправленным, а его обратная составляющая мощнее прямой.
Вторая проблема проиллюстрирована на рисунке 3. На верхнем графике рисунка показан ответ клетки «центр/окружение». Базовая схема реакции очень хорошо знакома нейробиологам, занимающимся зрением: стандартные ганглиозные клетки «центр/окружение» показывают кривую линии-отклика на пространственную частоту — максимальный отклик возникает, когда полоса решетки точно совпадает по ширине с участком «центр» рецептивного поля клетки «центр/окружение». Но теперь рассмотрим ответ одной из нестандартных клеток в зрительном нерве, полученном в том же эксперименте (рисунок 3 б). В этот раз клетка принадлежит к так называемому кониоцеллюлярному типу ганглиозных клеток, сводному набору нестандартных типов клеток, который обычно обобщается, если он вообще упоминается, как «путь синего цвета». Эта клетка обладает организацией по типу «подавление контрастом» [6,7,12,13], в данном эксперименте её ответ почти полностью противоположный ответу стандартной клетки «центр/окружение». При учете поправки на разницу в остроте зрения обезьян и кошек, ганглиозные клетки «подавления контрастом» ведут себя одинаково [12,13].
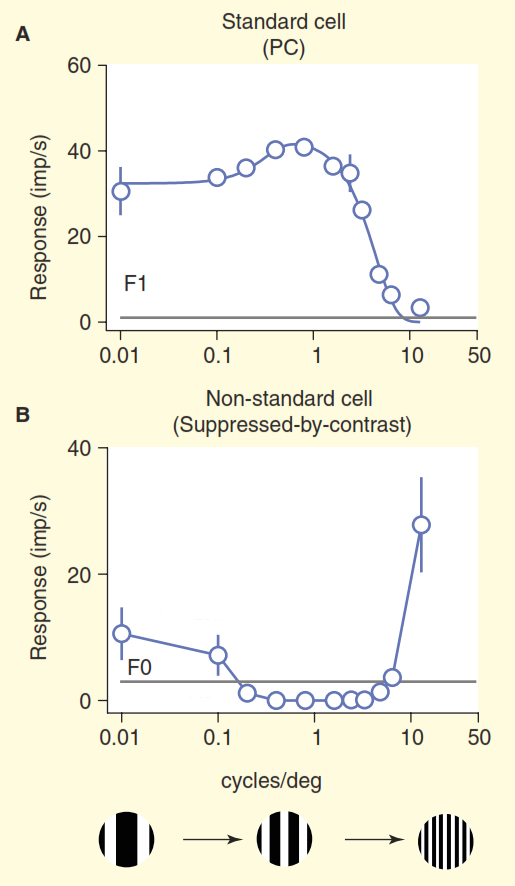
Рисунок 3. Сравнение стандартного и нестандартного рецептивного поля. Клетки стимулировались дрейфующей решеткой с изменяемой пространственной частотой (частота здесь выражается в виде общей ширины двух полос черной и белой в решетке на градус угла обзора). Стандартная «центр/окружение» ганглиозная клетка (A) ведет себя так, как и ожидалось: когда ширина полосы решетки близка к ширине центра рецептивного поля, клетка дает сильный ответ. Нестандартная клетка с «подавлением контрастом» (B) вместо возбуждения молчит, до тех пор пока способна различать черные и белые полосы.
Нам остается только предполагать, что эти клетки распознают монотонную заливку в зоне своей ответственности, например, чистое голубое небо, так как при уменьшении ширины белых и черных полос решетки ниже разрешающей способности человеческого глаза они сливаются в сплошной серый. Верного понимания о кодировании зрительной информации для этих клеток не представлено в стандартной модели зрения.
Все неприматы хорошо видят используя нестандартные клетки
Защитники принятой модели зрения при рассмотрении приматов могут ссылаться на относительно крайне малое количество нестандартных клеток, но это не относится к сетчаткам кроликов, кошек, крыс и мышей [7,8,14– 16]. Кроме того, в абсолютных числах (около 100 000) число нестандартных клеток в сетчатке приматов близко к общему количеству клеток в сетчатке крысы или кошки [17]. Острота зрения у кошек, кроликов, крыс и мышей ниже, чем у приматов, но острота это еще не все. Зрение всех этих существ позволяет успешно справляться с выживанием в дикой природе. Любому, кто сомневается в этом, предлагается попытаться подкрасться к кролику в поле или поймать мышь, не пользуясь мышеловкой (простая задача для обычной кошки).

Рисунок 4. Зрительное восприятие при низкой детализации.
Наблюдатели, знакомые с представленными на изображении персонами, распознают их несмотря на низкую детализацию. При размытии изображения для человека остается достаточно полезной зрительной информации. Слева направо: принц Чарльз, Вуди Аллен, Билл Клинтон, Саддам Хуссейн, Ричард Никсон, принцесса Диана.
Понятно, хотя бы по медицинским мотивам, почему нейробиологи сконцентрировались на сетчатке приматов. Но такая избирательная концентрация при попытке понимания зрения приводит к тому, что экспериментаторы привносят и переносят результаты самовосприятия на трактовку результатов проводимых исследований. Плотная упаковка ганглиозных клеток приматов хорошо подходит для обнаружения съедобных фруктов на дереве, или же для чтения свежего номера «Нью Йорк Таймс», но нет особых причин рассматривать такие задачи как summum bonum (лат.: высшее благо) зрения. В общей эволюционной картине эту крайне высокую остроту зрения можно рассматривать как специфическую нишевую адаптацию для обнаружения на большом расстоянии высококонтрастных объектов. У большинства млекопитающих в сетчатке нет фовеа (центральной ямки в сетчатке) — специализированной области с высокой остротой зрения, обнаруженной у приматов, — но зрение без миллиона плотно упакованных ганглиозных клеток остается вполне работоспособным. Доказательство проиллюстрировано на рисунке 4, люди легко способны к узнаванию без привычной остроты зрения [18]. У млекопитающих, не являющихся приматами, кодирование зрительных стимулов особенно хорошо изучено у кроликов [19–23]. У кроликов большие глаза, а оптическая система лучше, чем у многих видов приматов, так же в их сетчатке есть стандартные ганглиозные клетки «центр/окружение». Однако эти стандартные клетки составляют лишь четверть от всей популяции ганглиозных клеток сетчатки, представленной около двенадцатью функциональными и анатомическими типами [14,21]. Понятно, что каждый из этих двенадцати типов клеток заточен эволюцией под свои зрительные стимулы. Но важность данного факта заключается в том, что в зрительном потоке текущем в мозг кролика преобладают каналы именно от нестандартных ганглиозных клеток. Эта информация не нова: новшеством же является доказательство того, что сетчатка всех млекопитающих передает многообразие кодирующих зрительных каналов в мозг [4, 13, 24, 25] и что такое разнообразие должно быть включено в любой реалистичный взгляд на устройство зрения.
Известным примером являются клетки избирательно реагирующие на направление движения стимула. Один тип из них напрямую отправляет сигнал в ядра ствола мозга, связанные с движением глаз [26]. Но не столь общеизвестен другой тип этих клеток, сигнал от которых идет не только в средний мозг, но и через латеральные коленчатые тела в первичную зрительную кору [19]. Такие клетки не так уж и редки, однако упоминания о них в учебниках при описании устройства зрения не встречается. Сигнал от нестандартных ганглиозных клеток однозначно доходит до зрительной коры, но как он использует?
Второй нестандартный тип клеток (идентифицированный у кроликов, кошек и мышей) — это так называемый локальный детектор края. Подобно клеткам избирательно реагирующим на направление движения, они также когда-то считались редкими ганглиозными клетками, но теперь мы знаем, что это произошло из-за ошибки при использовании электродов: они, вероятно, составляют около 15% всех ганглиозных клеток [23]. Сигналы от этих клеток также достигают первичной зрительной коры, но их ответы лежат далеко за пределами стандартных зрительных реакций [8,22,23]. Эти клетки лучше всего реагируют на небольшие, медленно движущиеся цели, такие как хищник или хищное животное, двигающееся на удаленном расстоянии. Однако, если есть много мелких объектов, как на текстурированном поле, клетки перестают реагировать. Другими словами, клетки реагируют на небольшой движущийся объект, но только тогда, когда он в одиночестве.
Локальный детектор края, по-видимому, является наиболее многочисленным типом ганглиозных клеток сетчатки у кролика, но он не был включен в стандартную модель зрения. Могут ли эти клетки сформировать систему анализа движения на удаленных расстояниях? Как зрительная кора обрабатывает сигналы от этих клеток? Как другие виды млекопитающих воспринимают мир стандартными ганглиозными клетками и локальными детекторами краев — или даже клетками с другим сжатием зрительной информации, который еще предстоит обнаружить?
Зрительная кора умнее, чем признают учебники
Даже если сделать допущение, что весь зрительный поток кодируется только стандартными клетками сетчатки, на данный момент времени известно, что обработка в первичной зрительной коре не происходит исключительно по первоначально предложенному способу с помощью «простых», «сложных», «гиперсложных» нейронов, а также нейронов «с концевым торможением». Обсуждению данного факта уделено много места в специализированной литературе [27–30].
Проблемы начинаются с другого очевидного факта, что почти все нейроны в коре мозга нелинейны, что ставит под сомнение полезность иерархических схем с линейными допущениями в трактовке их функции [31,32].
Во-вторых, идея трех основных типов клеток – «простых», «сложных» и «гиперсложных» — является грубой абстракцией богатого разнообразия типов клеток первичной зрительной коры, выявленных анатомическими методами [33,34]. В-третьих, нейроны зрительной коры зависят не только от входящего зрительного потока, но и от различных контекстных сигналов своих соседей, так что реакция на те же стимулы являющиеся частью картины повседневности и искусственно созданными экспериментаторами может разниться [27,35]. Ответы нейронов зрительной коры даже не фиксированы во времени: удаление небольшого участка сетчатки, которое приводит к появлению слепого пятна, позволяет нейронам оставшимся без работы со временем сменить свою зону ответственности и обрабатывать зрительную информацию из ближайших к слепому пятну рабочих участков сетчатки [36].
С точки зрения анатомии ничего из перечисленного не является удивительным. Только до 10% от входа отдельного нейрона поступает из каналов зрительного потока [37], остальное приходит от соседних нейронов или от нейронов, расположенных в отдаленных вышестоящих частях коры головного мозга, где зрительные нейроны еще малоизучены и трактовка их функций составляет собой трудную задачу.
Таким образом, становится очевидным, что стандартное представление об устройстве зрения застряло в болоте догм. Какие шаги стоит предпринять, чтобы выбраться из него?
Шаг 1: пересмотр основ
Последние хорошие новости заключаются в том, что методы визуализации клеток сетчатки за последние 5 лет претерпели незаметную революцию, так что теперь легко визуализировать их в больших количествах и с беспрецедентным качеством разрешения в виде трехмерного изображения. Проблема нахождения синапсов и взаимного расположения клеток легко разрешается, теперь и их можно классифицировать не только «на глаз», но и с помощью объективных методов классификации [15,16]. Степень соответствия морфологической типизации к физиологической типизации клеток сетчатки показывает прямую связь (рассмотрено в [24]). Таким образом структурные типы ганглиозных клеток сетчатки точно определяют количество функциональных каналов в зрительном потоке.
Во всех зрительных системах млекопитающих, изученных к настоящему времени, анатомические данные указывают на то, что число функциональных каналов составляет приблизительно двенадцать. В сетчатке обезьяны и кошки хорошо изучены функции примерно половины этих каналов. У кролика эта доля составляет около трети, сетчатки мыши и крысы, несмотря на их явное преимущество для генетических исследований, остаются в основном неизученными.
Таким образом, может оказаться полезным вернуться, вооружившись современными методами, к незавершенному делу 1970-х годов [38]. Задача состоит в том, чтобы завершить определение функций ганглиозных клеток, первого этапа сжатия зрительной информации, — избавится от слепых пятен в самом начале — и обновить свои цели в остальной части зрительной системы.
Шаг Исправить стимулы
Почему после более чем полувека исследований, знания о физиологии зрения так сильно отстают от знаний анатомии, и что можно сделать для улучшения ситуации? Отодвигая в сторону проблему избирательности исследований с помощью электрода, основной проблемой остается выбор методики для поиска верного стимула.
Понять, для чего именно используются в системе зрения ганглиозные клетки сетчатки и нейроны в первичной зрительной коре – какова их настройка на характеристики видимого окружения – оказывается гораздо сложнее, чем предполагали пионеры нейробиологии. Классическая техника исследования заключалась в том, что экспериментаторы слушали усиленный сигнал с электрода случайным образом погруженный в зрительный нерв или в кору мозга в то время как вручную передвигали проецируемый на сетчатку стимул в поисках зоны ответственности клетки к которой и прикоснулся электрод. Быстрый и эффективный метод, но страдающий субъективностью и недостаточной воспроизводимостью. Простые решетчатые стимулы и линейный системный анализ чрезвычайно эффективны для стандартных клеток [38,39], но, как говорилось ранее, этот метод плохо подходит к исследованию нестандартных клеток и нелинейных нейронов первичной зрительной коры. Интересны новые попытки определить наборы верных стимулов [40], но консенсуса пока нет.
Альтернатива основана на стратегии обратной корреляции [41–43], где случайно выбранный экспериментатором стимул предъявляется множество раз, а ответная реакция клетки используется для расчета обратного усреднения. Таким образом, экспериментатор может построить представление усредненного стимула, приводящего к самой активной реакции клетки. Большое преимущество этого метода заключается в том, что он не предполагает какой-либо конкретной настройки клетки на тестовый стимул. Как по теоретическим, так и по аналитическим причинам, тестовый стимул обычно выбирается как «случайный»: мерцающая шахматная доска или какая-либо другая форма визуального шума. Эта стратегия элегантна с точки зрения концепции, но в значительной степени ограничена анализом клеток со стандартной организацией «центр/окружение», поскольку нестандартные клетки (по определению) настроены на весьма неслучайные особенности зрительной информации.
Другая альтернатива использует более радикальный подход. Стратегия заключается в поиске обратной корреляции отклика клетки на изображение, снятом на видео в повседневной обстановке и предъявленном на экране монитора[27,44]. Идея заключается в том, что исследователь ждет от клетки сигнал, когда появится важный для неё стимул. Работоспособность такого метода была доказана экспериментально, но остается открытым вопрос насколько естественным следует считать двухмерное изображение, как этот метод будет учитывать эффекты нелинейности и контекста, и тем более как трактовать результаты.
Новая общая теория зрения?
Обратное сопоставление окружающего мира сигналам в мозге можно рассматривать как эмпиризм, доведенный до крайности. Но что могут предложить теоретики от нейробиологии в противовес своим коллегам экспериментаторам? У них есть возможность успешно выйти за рамки популярного в настоящее время стиля, с формальной точки зрение являющимся лишь переформулированием экспериментальных результатов. Не смотря на четверть века усилий, большая часть проведенной работы не смогла пройти проверку временем и не нашла подтверждения в новых экспериментальных фактах. Хотя точные и компактные формулировки экспериментальных результатов имеют важное значение, они редко приводят к синтезу новых знаний, а стремление к удобству математической оценки данных может накладывать невидимые ограничения на проводимые эксперименты. Конкретный пример был приведен ранее: если экспериментальный метод ограничен предъявлением в виде стимула решеток переменной ширины, ганглиозная клетка с организацией по типу «подавление контрастом» появляется только как «выброс» в экспериментальных данных, о котором исследователь не может сказать ничего другого.
Чем же тогда могут помочь теоретики? Им стоит разобраться с неудобными с вычислительной точки зрения аспектами реальной нервной системы. Например, экспериментальные физиологи слишком хорошо знают, что сенсорные системы являются линейными, только когда экспериментатор заставляет их быть такими [27,38,45]. Широкий охват теории зрения необходим, чтобы справляться с такими задачами как понимание достоинств избыточного и разреженного кодирования в зрительных системах, необходимость протянуть мосты между исследованиями зрения у беспозвоночных и позвоночных [46,47]. Вопрос состоит в том, даст ли результат переосмысление первого этапа в сжатии зрительной информации в сетчатке [46,48–50]. Ранее подчеркивалось разнообразие функциональных каналов зрительного потока, который при всем своем разнообразии служит нам в виде столь привычного чувства – зрения. В итоге главной задачей так и останется узнать каким образом мы просто «видим» и как вообще мы сможем это понять?
References
1. Casagrande V.A. (1994). A third parallel visual pathway to primate area V1. Trends Neurosci. 17, 305–310.
2. Hendry S.H.C., and Reid R.C. (2000). The koniocellular pathway in primate vision. Ann. Rev. Neurosci. 23, 127–153.
3. White A.J.R., Solomon S.G., and Martin P.R. (2001). Spatial properties of koniocellular cells in the lateral geniculate nucleus of the marmoset Callithrix jacchus. J. Physiol. 533, 519–535.
4. Dacey D.M., Peterson B.B., Robinson F.R., and Gamlin P.D. (2003). Fireworks in the primate retina: in vitro photodynamics reveals diverse LGN-projecting ganglion cell types. Neuron 37, 15–27.
5. Sincich L.C., Park K.F., Wohlgemuth M.J., and Horton J.C. (2004). Bypassing V1: a direct geniculate input to area MT. Nat. Neurosci. 7, 1123–1128.
6. Rodieck R.W. (1967). Receptive fields in the cat retina: a new type. Science 157, 90–92.
7. Stone J. and Hoffmann K.-P. (1972). Very slow-conducting ganglion cells in the cat’s retina: a major, new functional type? Brain Res. 43, 610–616.
8. Cleland B.G., Levick W.R., Morstyn R., and Wagner H.G. (1976). Lateral geniculate relay of slowly-conducting retinal afferents to cat visual cortex. J. Physiol. 255, 299–320.
9. DeMonasterio F.M. (1978). Properties of ganglion cells with atypical receptive-field organization in retina of macaques. J. Neurophysiol. 41, 1435–1449.
10. Yukie M., and Iwai E. (1981). Direct projection from the dorsal lateral geniculate nucleus to the prestriate cortex in macaque monkeys. J. Comp. Neurol. 201, 81–97.
11. Hubel D.H., and Wiesel T.N. (1977). Ferrier lecture. Functional architecture of macaque monkey visual cortex. Proc. R. Soc. Lond. Ser. B Biol. Sci. 198, 1–59.
12. Troy J.B., Einstein G., Schuurmans R.P., Robson J.G., and Enroth-Cugell C.H. (1989). Responses to sinusoidal gratings of two types of very nonlinear retinal ganglion cells of cat. Visual Neurosci. 3, 213–223.
13. Tailby C., Solomon S.G., Dhruv N.T., Majaj N.J., Sokol S.H., and Lennie P. (2007). A new code for contrast in the primate visual pathway. J. Neurosci. 27, 3904–3909.
14. Rockhill R.L., Daly F.J., MacNeil M.A., Brown S.P., and Masland R.H. (2002). The Diversity of ganglion cells in a mammalian retina. J. Neurosci. 22, 3831–3843.
15. Badea T.C., and Nathans J. (2004). Quantitative analysis of neuronal morphologies in the mouse retina visualized by using a genetically directed reporter. J. Comp. Neurol. 480, 331–351.
16. Kong J.H., Fish D.R., Rockhill R.L., and Masland R.H. (2005). Diversity of ganglion cells in the mouse retina: Unsupervised morphological classification and its limits. J. Comp. Neurol. 489, 293–310.
17. Wassle H. (2004). Parallel processing in the mammalian retina. Nat. Rev. Neurosci. 5, 747–757.
18. Sinha P. (2002). Recognizing complex patterns. Nat. Neurosci. 5 Suppl, 1093–1097.
19. Levick W.R., Oyster C.W., and Takahashi E. (1969). Rabbit lateral geniculate nucleus: sharpener of directional information. Science 165, 712–714.
20. DeVries S.H., and Baylor D.A. (1997). Mosaic arrangement of ganglion cell receptive fields in rabbit retina. J. Neurophysiol. 78, 2048–2060.
21. Roska B., and Werblin F. (2001). Vertical interactions across ten parallel, stacked representations in the mammalian retina. Nature 410, 583–587.
22. Zeck G.M., Xiao Q., and Masland R.H. (2005). The spatial filtering properties of local edge detectors and brisk-sustained retinal ganglion cells. Eur. J. Neurosci. 22, 2016–2026.
23. van Wyk M., Taylor W.R., and Vaney D.I. (2006). Local edge detectors: a substrate for fine spatial vision at low temporal frequencies in rabbit retina. J. Neurosci. 26, 13250–13263.
24. Masland R.H. (2001). Neuronal diversity in the retina. Curr. Opin. Neurobiol. 11, 431–436.
25. Dacey D.M., Liao H.W., Peterson B.B., Robinson F.R., Smith V.C., Pokorny J., Yau K.W., and Gamlin P.D. (2005). Melanopsinexpressing ganglion cells in primate retina signal colour and irradiance and project to the LGN. Nature 433, 749–754.
26. Simpson J.I. (1984). The accessory optic system. Ann. Rev. Neurosci. 7, 13–41.
27. Carandini M., Demb J.B., Mante V., Tolhurst D.J., Dan Y., Olshausen B.A., Gallant J.L., and Rust N.C. (2005). Do we know what the early visual system does? J. Neurosci. 25, 10577–10597.
28. Olshausen B.A., and Field D.J. (2004). Sparse coding of sensory inputs. Curr. Opin Neurobiol. 14, 481–487.
29. Simoncelli E.P., and Olshausen B.A. (2001). Natural image statistics and neural representation. Ann. Rev. Neurosci. 24, 1193–1216.
30. Olshausen B.A., and Field D.J. (2005). How close are we to understanding v1? Neural. Comput. 17, 1665–1699.
31. Ferster D., and Miller K.D. (2000). Neural mechanisms of orientation selectivity in the visual cortex. Ann. Rev. Neurosci. 23, 441–471.
32. Anderson J.S., Lampl I., Gillespie D.C., and Ferster D. (2001). Membrane potential and conductance changes underlying length tuning of cells in cat primary visual cortex. J. Neurosci. 21, 2104–2112.
33. Lund J.S., and Yoshioka T. (1991). Local circuit neurons of macaque monkey striate cortex: III. Neurons of laminae 4B, 4A, and 3B. J. Comp. Neurol. 311, 234–258.
34. Cauli B., Audinat E., Lambolez B., Angulo M.C., Ropert N., Tsuzuki K., Hestrin S., and Rossier J. (1997). Molecular and physiological diversity of cortical nonpyramidal cells. J. Neurosci. 17, 3894–3906.
35. Zipser K., Lamme V.A., and Schiller P.H. (1996). Contextual modulation in primary visual cortex. J. Neurosci. 16, 7376-7389.
36. Gilbert C.D., Sigman M., and Crist R.E. (2001). The neural basis of perceptual learning. Neuron 31, 681–697.
37. Douglas R.J., and Martin K.A. (2004). Neuronal circuits of the neocortex. Ann. Rev. Neurosci. 27, 419–451.
38. Troy J.B., and Shou T. (2002). The receptive fields of cat retinal ganglion cells in physiological and pathological states: where we are after half a century of research. Prog. Ret. Eye Res. 21, 263–302.
39. Lennie P., and Movshon J.A. (2005). Coding of color and form in the geniculostriate visual pathway. J. Opt. Soc. Am. 22, 2013–2033.
40. Victor J.D. (2005). Analyzing receptive fields, classification images and functional images: challenges with opportunities for synergy. Nat. Neurosci. 8, 1651–1656.
41. Srinivasan M.V., Jin Z.F., Stange G., and Ibbotson M.R. (1993). ‘Vector white noise’: a technique for mapping the motion receptive fields of direction-selective visual neurons. Biol. Cybern. 68, 199–207.
42. Meister M., and Berry M.J. (1999). The neural code of the retina. Neuron 22, 435–450.
43. Kara P., Reinagel P., and Reid R.C. (2000). Low response variability in simultaneously recorded retinal, thalamic, and cortical neurons. Neuron 27, 635–646.
44. Ringach D.L., Hawken M.J., and Shapley R. (2002). Receptive field structure of neurons in monkey primary visual cortex revealed by stimulation with natural image sequences. J. Vision 2, 12–24.
45. Schwartz O., and Simoncelli E.P. (2001). Natural signal statistics and sensory gain control. Nat. Neurosci. 4, 819–825.
46. Horridge A. (2000). Seven experiments on pattern vision of the honeybee, with a model. Vision Res. 40, 2589-2603.
47. Srinivasan M.V. (2006). Honeybee vision: in good shape for shape recognition. Curr. Biol. 16, R58–60.
48. Marr D. (1982). Vision: A Computational Investigation in the Human Representation and Processing of Visual Information (New York: W. H. Freeman).
49. Barlow H.B. (1997). The knowledge used in vision and where it comes from. Phil.Trans. Roy. Soc. Lond. B 352, 1141–1147.
50. Riesenhuber M., and Poggio T. (2000). Models of object recognition. Nat. Neurosci. 3, 1199–1204.
2. Hendry S.H.C., and Reid R.C. (2000). The koniocellular pathway in primate vision. Ann. Rev. Neurosci. 23, 127–153.
3. White A.J.R., Solomon S.G., and Martin P.R. (2001). Spatial properties of koniocellular cells in the lateral geniculate nucleus of the marmoset Callithrix jacchus. J. Physiol. 533, 519–535.
4. Dacey D.M., Peterson B.B., Robinson F.R., and Gamlin P.D. (2003). Fireworks in the primate retina: in vitro photodynamics reveals diverse LGN-projecting ganglion cell types. Neuron 37, 15–27.
5. Sincich L.C., Park K.F., Wohlgemuth M.J., and Horton J.C. (2004). Bypassing V1: a direct geniculate input to area MT. Nat. Neurosci. 7, 1123–1128.
6. Rodieck R.W. (1967). Receptive fields in the cat retina: a new type. Science 157, 90–92.
7. Stone J. and Hoffmann K.-P. (1972). Very slow-conducting ganglion cells in the cat’s retina: a major, new functional type? Brain Res. 43, 610–616.
8. Cleland B.G., Levick W.R., Morstyn R., and Wagner H.G. (1976). Lateral geniculate relay of slowly-conducting retinal afferents to cat visual cortex. J. Physiol. 255, 299–320.
9. DeMonasterio F.M. (1978). Properties of ganglion cells with atypical receptive-field organization in retina of macaques. J. Neurophysiol. 41, 1435–1449.
10. Yukie M., and Iwai E. (1981). Direct projection from the dorsal lateral geniculate nucleus to the prestriate cortex in macaque monkeys. J. Comp. Neurol. 201, 81–97.
11. Hubel D.H., and Wiesel T.N. (1977). Ferrier lecture. Functional architecture of macaque monkey visual cortex. Proc. R. Soc. Lond. Ser. B Biol. Sci. 198, 1–59.
12. Troy J.B., Einstein G., Schuurmans R.P., Robson J.G., and Enroth-Cugell C.H. (1989). Responses to sinusoidal gratings of two types of very nonlinear retinal ganglion cells of cat. Visual Neurosci. 3, 213–223.
13. Tailby C., Solomon S.G., Dhruv N.T., Majaj N.J., Sokol S.H., and Lennie P. (2007). A new code for contrast in the primate visual pathway. J. Neurosci. 27, 3904–3909.
14. Rockhill R.L., Daly F.J., MacNeil M.A., Brown S.P., and Masland R.H. (2002). The Diversity of ganglion cells in a mammalian retina. J. Neurosci. 22, 3831–3843.
15. Badea T.C., and Nathans J. (2004). Quantitative analysis of neuronal morphologies in the mouse retina visualized by using a genetically directed reporter. J. Comp. Neurol. 480, 331–351.
16. Kong J.H., Fish D.R., Rockhill R.L., and Masland R.H. (2005). Diversity of ganglion cells in the mouse retina: Unsupervised morphological classification and its limits. J. Comp. Neurol. 489, 293–310.
17. Wassle H. (2004). Parallel processing in the mammalian retina. Nat. Rev. Neurosci. 5, 747–757.
18. Sinha P. (2002). Recognizing complex patterns. Nat. Neurosci. 5 Suppl, 1093–1097.
19. Levick W.R., Oyster C.W., and Takahashi E. (1969). Rabbit lateral geniculate nucleus: sharpener of directional information. Science 165, 712–714.
20. DeVries S.H., and Baylor D.A. (1997). Mosaic arrangement of ganglion cell receptive fields in rabbit retina. J. Neurophysiol. 78, 2048–2060.
21. Roska B., and Werblin F. (2001). Vertical interactions across ten parallel, stacked representations in the mammalian retina. Nature 410, 583–587.
22. Zeck G.M., Xiao Q., and Masland R.H. (2005). The spatial filtering properties of local edge detectors and brisk-sustained retinal ganglion cells. Eur. J. Neurosci. 22, 2016–2026.
23. van Wyk M., Taylor W.R., and Vaney D.I. (2006). Local edge detectors: a substrate for fine spatial vision at low temporal frequencies in rabbit retina. J. Neurosci. 26, 13250–13263.
24. Masland R.H. (2001). Neuronal diversity in the retina. Curr. Opin. Neurobiol. 11, 431–436.
25. Dacey D.M., Liao H.W., Peterson B.B., Robinson F.R., Smith V.C., Pokorny J., Yau K.W., and Gamlin P.D. (2005). Melanopsinexpressing ganglion cells in primate retina signal colour and irradiance and project to the LGN. Nature 433, 749–754.
26. Simpson J.I. (1984). The accessory optic system. Ann. Rev. Neurosci. 7, 13–41.
27. Carandini M., Demb J.B., Mante V., Tolhurst D.J., Dan Y., Olshausen B.A., Gallant J.L., and Rust N.C. (2005). Do we know what the early visual system does? J. Neurosci. 25, 10577–10597.
28. Olshausen B.A., and Field D.J. (2004). Sparse coding of sensory inputs. Curr. Opin Neurobiol. 14, 481–487.
29. Simoncelli E.P., and Olshausen B.A. (2001). Natural image statistics and neural representation. Ann. Rev. Neurosci. 24, 1193–1216.
30. Olshausen B.A., and Field D.J. (2005). How close are we to understanding v1? Neural. Comput. 17, 1665–1699.
31. Ferster D., and Miller K.D. (2000). Neural mechanisms of orientation selectivity in the visual cortex. Ann. Rev. Neurosci. 23, 441–471.
32. Anderson J.S., Lampl I., Gillespie D.C., and Ferster D. (2001). Membrane potential and conductance changes underlying length tuning of cells in cat primary visual cortex. J. Neurosci. 21, 2104–2112.
33. Lund J.S., and Yoshioka T. (1991). Local circuit neurons of macaque monkey striate cortex: III. Neurons of laminae 4B, 4A, and 3B. J. Comp. Neurol. 311, 234–258.
34. Cauli B., Audinat E., Lambolez B., Angulo M.C., Ropert N., Tsuzuki K., Hestrin S., and Rossier J. (1997). Molecular and physiological diversity of cortical nonpyramidal cells. J. Neurosci. 17, 3894–3906.
35. Zipser K., Lamme V.A., and Schiller P.H. (1996). Contextual modulation in primary visual cortex. J. Neurosci. 16, 7376-7389.
36. Gilbert C.D., Sigman M., and Crist R.E. (2001). The neural basis of perceptual learning. Neuron 31, 681–697.
37. Douglas R.J., and Martin K.A. (2004). Neuronal circuits of the neocortex. Ann. Rev. Neurosci. 27, 419–451.
38. Troy J.B., and Shou T. (2002). The receptive fields of cat retinal ganglion cells in physiological and pathological states: where we are after half a century of research. Prog. Ret. Eye Res. 21, 263–302.
39. Lennie P., and Movshon J.A. (2005). Coding of color and form in the geniculostriate visual pathway. J. Opt. Soc. Am. 22, 2013–2033.
40. Victor J.D. (2005). Analyzing receptive fields, classification images and functional images: challenges with opportunities for synergy. Nat. Neurosci. 8, 1651–1656.
41. Srinivasan M.V., Jin Z.F., Stange G., and Ibbotson M.R. (1993). ‘Vector white noise’: a technique for mapping the motion receptive fields of direction-selective visual neurons. Biol. Cybern. 68, 199–207.
42. Meister M., and Berry M.J. (1999). The neural code of the retina. Neuron 22, 435–450.
43. Kara P., Reinagel P., and Reid R.C. (2000). Low response variability in simultaneously recorded retinal, thalamic, and cortical neurons. Neuron 27, 635–646.
44. Ringach D.L., Hawken M.J., and Shapley R. (2002). Receptive field structure of neurons in monkey primary visual cortex revealed by stimulation with natural image sequences. J. Vision 2, 12–24.
45. Schwartz O., and Simoncelli E.P. (2001). Natural signal statistics and sensory gain control. Nat. Neurosci. 4, 819–825.
46. Horridge A. (2000). Seven experiments on pattern vision of the honeybee, with a model. Vision Res. 40, 2589-2603.
47. Srinivasan M.V. (2006). Honeybee vision: in good shape for shape recognition. Curr. Biol. 16, R58–60.
48. Marr D. (1982). Vision: A Computational Investigation in the Human Representation and Processing of Visual Information (New York: W. H. Freeman).
49. Barlow H.B. (1997). The knowledge used in vision and where it comes from. Phil.Trans. Roy. Soc. Lond. B 352, 1141–1147.
50. Riesenhuber M., and Poggio T. (2000). Models of object recognition. Nat. Neurosci. 3, 1199–1204.